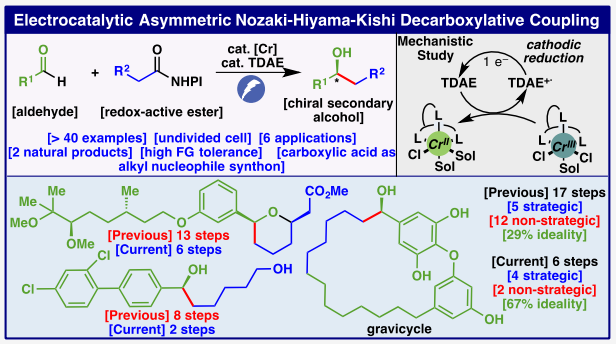
40多年來,手性仲醇的合成一直是化學家們研究的熱點(Figure 1A)。合成芳基-烷基取代仲醇的兩種主要途徑是對醛進行親核加成和對酮進行不對稱還原。Nozaki-Hiyama-Kishi反應于1977年首次發現,其使用化學計量的Cr和催化量的Ni,通過烯基鹵化物與醛的交叉偶聯來實現烯丙醇產物的合成。然而,該反應卻很少用于烷基鹵化物。近年來,盡管化學家們發展了一系列烷基親核試劑替代物,如烷基碘化物,羧酸(通過氧化還原活性酯(RAEs)),烯烴,甚至非活化C-H鍵(Figure 1B)。然而到目前為止,還沒有以高度對映選擇性實現該轉化的報道。最近,美國加州理工學院Sarah E. Reisman課題組和美國斯克里普斯研究所Phil S. Baran課聯合報道了首例對映選擇性烷基-Nozaki-Hiyama-Kishi偶聯反應。其使用Cr-電催化的脫羧策略,在溫和的電催化還原條件下以良好的產率和對映選擇性實現了一系列手性仲醇的合成(Figure 1C)。下載化學加APP到你手機,收獲更多商業合作機會。首先,作者對反應條件進行了優化(Table 1)。當使用醛4(0.8 mmol),氧化還原活性酯5(2.0 equiv),在CrCl2(30 mol%),L7(33 mol%),Proton Sponge (33 mol%),TESCl(2.0 equiv),TDAE(0.4 equiv),TBAClO4(0.1 M),(+)Al/(-)Ni foam,MeCN (c = 0.5 M),2.5 mA,室溫反應24小時后用TBAF后處理,可以以58%的核磁產率,90% ee得到相應的手性仲醇產物6。 在得到了最優反應條件后,作者對此轉化的底物范圍進行了探索(Table 2)。實驗結果表明,一系列不同取代的氧化還原活性酯與醛均具有良好的兼容性,以32-71%的產率,80-91%ee得到相應的手性仲醇產物7-47。值得注意的是,此轉化對一系列生物活性分子骨架,如linoleic acid, chlorambucil, elaidic acid, naproxen等均具有良好的兼容性。遺憾的是,此轉化對硝基、苯腈以及吡啶基不能兼容(49-51)。 利用作者所發展的電催化不對稱NHK脫羧偶聯策略,可以大大簡化分子的合成路線。這主要是由于此策略采用了基于自由基的逆合成策略,這與傳統用于合成仲醇的傳統2e-策略有所不同。例如,之前的合成方法需要經歷包括官能團轉換等五步來實現炔54的合成,而利用此策略可以從53開始僅用兩步即可實現54的制備(Figure 2A)。天然產物全合成中的二醇中間體58,傳統方法制備消旋的產物需要經歷六步,而利用此方法僅需三步即可以良好的對映選擇性實現手性產物58的合成(Figure 2B)。對于藥物相關的二醇63,之前的策略需要八步,而現有策略僅需兩步(Figure 2C)。值得注意的是,使用簡單易得的RAE 64,僅通過兩步即可實現horsfieldone A的首次全合成(Figure 2D)。 此外,利用此策略還可以實現更復雜分子的合成(Figure 3)。例如,herboxidiene類似物70,之前報道的方法需要經歷十三步合成。而利用醛68作為起始原料,通過所發展的e-NHK偶聯(35%,94:6 dr)以及隨后的環化(44%),僅需六步即可實現70的合成(Figure 3A)。而之前所報道的gravicycle (78)的十七步合成也可以利用此策略,僅使用簡單的芳基碘74作為起始原料,通過與RAE 75的電催化DCC-芳基化(51%)、與76的Ullman偶聯、與RAE 77的e-NHK(46%,82%ee)、RCM(71%)以及脫保護(92%)六步得到目標產物78(Figure 3B)。 最后,作者對此轉化的反應機理進行了探索(Figure 4),并得出如下結論:1)無論化學計量反應還是催化反應條件均涉及到假定的烷基鉻物種的形成,并且該中間體的形成不需要TDAE。因此,在電催化體系中,TDAE介導了L7·CrIII的還原。2)CV實驗表明,配體增加了絡合物的還原電位或增加了過電位(overpotential),并進一步證實了TDAE的作用是介導L7·CrIII絡合物的還原。 Sarah E. Reisman和Phil S. Baran課題組聯合報道了首例Cr-電共催化的對映選擇性烷基-Nozaki-Hiyama-Kishi (NHK)偶聯反應。該反應利用簡單的伯烷基底物與醛的加成,高對映選擇性的實現一系列手性仲醇的合成。此不對稱烷基e-NHK反應實現的關鍵是通過使用TDAE作為關鍵的還原介質。CV研究和化學計量實驗表明,TDAE的作用是介導L7·CrIII絡合物的還原,而在之前的非不對稱烷基e-NHK中,這一過程是決速步驟。而這對于不對稱反應特別有利,由于在不對稱反應中,手性配體在電極處實現緩慢地的催化劑的還原。因此使用催化量TDAE介導對于避免烷基自由基和TDAE+?之間的競爭HAT過程至關重要。此外,該策略可以有效減少多種藥物相關結構和天然產物的合成步數,進一步證明了此轉化的實用性。 文獻詳情:
Yang Gao, Baiyang Jiang, Nathan C. Friede, Arianne C. Hunter, Dylan G. Boucher, Shelley D. Minteer, Matthew S. Sigman, Sarah E. Reisman*, Phil S. Baran*. Electrocatalytic Asymmetric Nozaki–Hiyama–Kishi Decarboxylative Coupling: Scope, Applications, and Mechanism. J. Am. Chem. Soc., 2024, https://doi.org/10.1021/jacs.3c13442.







