



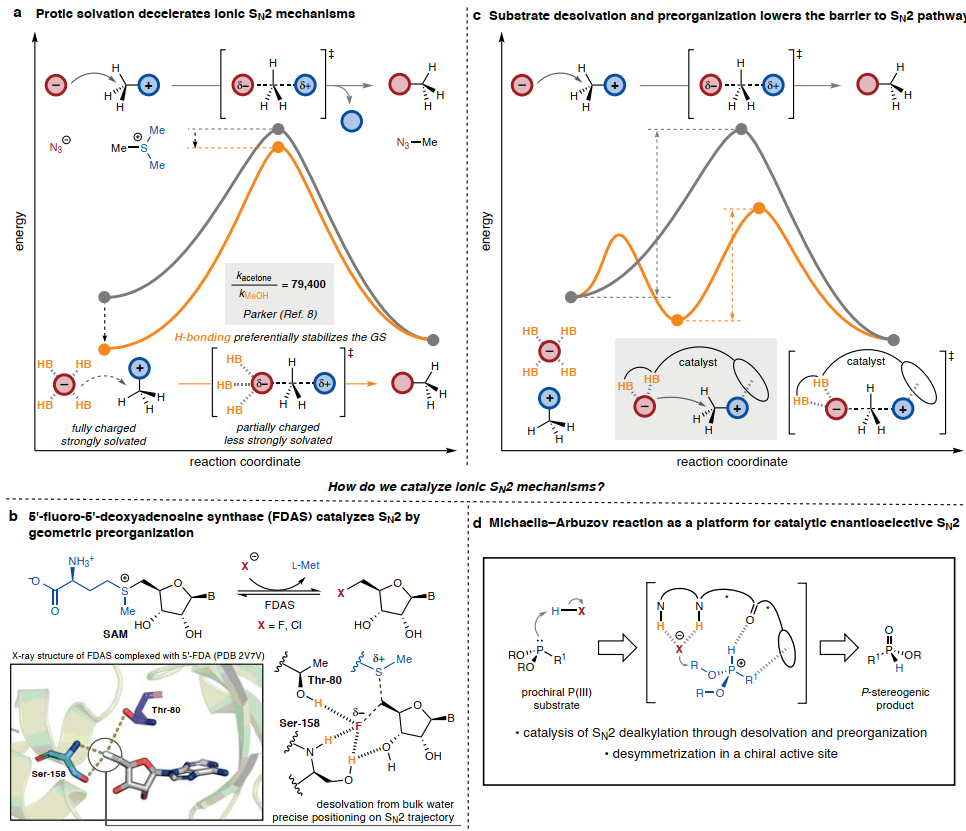
圖1. 將酶策略應(yīng)用于離子SN2機(jī)制的催化
正文
雙分子親核取代(SN2)機(jī)制在有機(jī)化學(xué)領(lǐng)域的歷史發(fā)展和教學(xué)中占據(jù)著核心地位。帶電物質(zhì)之間的雙分子SN2途徑在極性非質(zhì)子溶劑中通常比在質(zhì)子溶劑中進(jìn)行得更快(圖1A)。而涉及離子SN2機(jī)制的反應(yīng)的選擇性催化必須克服這樣一個(gè)事實(shí):任何與離子對(duì)的明確靜電相互作用都可能使反應(yīng)物相對(duì)于過(guò)渡態(tài)穩(wěn)定,并導(dǎo)致速率衰減而不是加速。
在促進(jìn)SN2機(jī)制的少數(shù)酶類中,大多數(shù)采用一般酸堿催化來(lái)激活不帶電的親核試劑或親電試劑。親核鹵化酶5'-氟-5'-脫氧腺苷合酶(FDAS)的另一種催化模式已有報(bào)道,其促進(jìn)陽(yáng)離子S-腺苷甲硫氨酸(SAM)上的氟化物(或氯化物)置換 (圖1B)。固態(tài)X-射線結(jié)構(gòu)表征(圖1B)以及立體化學(xué)、理論和動(dòng)力學(xué)研究已確定該酶通過(guò)鹵化物結(jié)合活性位點(diǎn)實(shí)現(xiàn)速率加速~106 (i)將鹵化物精確定位在與離去基團(tuán)的共線關(guān)系中和(ii)提供“鹵化物空穴”以抵消親核試劑從水中脫溶的能量損失。在這種酶促機(jī)制中,酶活性位點(diǎn)被預(yù)先組織起來(lái),以穩(wěn)定幾何上類似于過(guò)渡態(tài)的“近進(jìn)攻”基態(tài)構(gòu)象。作者設(shè)想了一種仿生方法來(lái)設(shè)計(jì)用于離子SN2機(jī)制的小分子催化劑,并以FDAS結(jié)構(gòu)-機(jī)制關(guān)系為指導(dǎo)。作者假設(shè),如果催化劑能夠(i)精確地將離子對(duì)預(yù)組織成適合SN2 親核取代的幾何構(gòu)型,并且(ii)為親核試劑提供直接溶劑化殼(圖1C),則成功的催化是可行的。
作者選擇了Michaelis-Arbuzov反應(yīng)來(lái)探索,Arbuzov反應(yīng)中的關(guān)鍵步驟是磷中間體的 SN2脫烷基化,這一基本步驟也是有機(jī)磷化合物合成中其他多種重要反應(yīng)的基礎(chǔ)。設(shè)想的轉(zhuǎn)化始于具有兩個(gè)相同烷氧基取代基的非手性P(III)物種,在形成四面體膦陽(yáng)離子后,它們將呈現(xiàn)用于SN2脫烷基化的對(duì)映位點(diǎn)(圖1D)。如果SN2步驟是周轉(zhuǎn)限制,那么實(shí)現(xiàn)高選擇性還需要催化劑加速SN2步驟而不是外消旋未催化的反應(yīng)。本文中,精確設(shè)計(jì)的手性 HBD加速了高對(duì)映選擇性Michaelis-Arbuzov反應(yīng)中膦鹵化物離子對(duì)中間體的 SN2脫烷基化(圖1C)。所得的H-膦酸酯產(chǎn)物是制備立體異構(gòu)體-磷(V)化合物的多功能中間體。
(圖片來(lái)源:Nature)
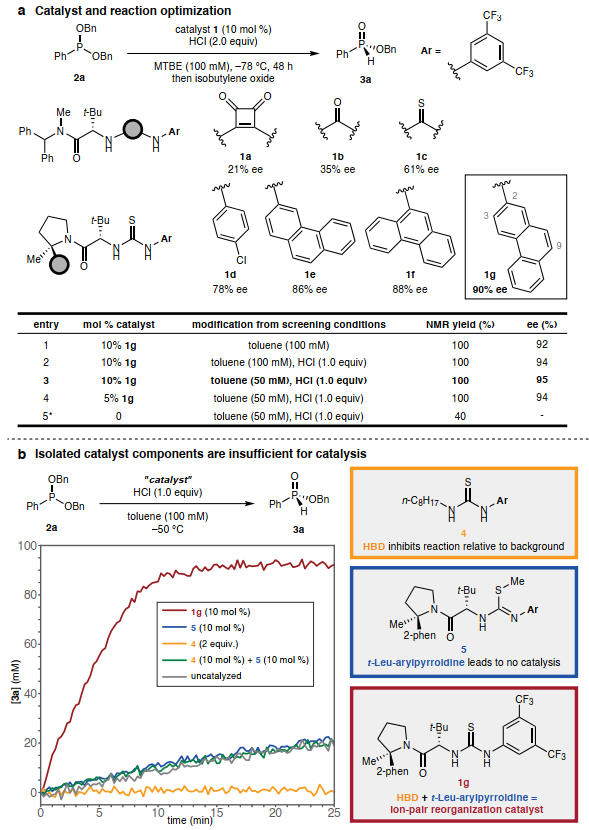
對(duì)Arbuzov反應(yīng)類型與手性HBD催化劑的實(shí)證研究表明,二芐基苯基亞膦酸酯 2a與HCl的脫烷基化具有良好的對(duì)映選擇性(圖2A)。最終,帶有2-菲基取代基的硫脲1g以90% ee和定量產(chǎn)率促進(jìn)了脫烷基化。將反應(yīng)溶劑改為甲苯(圖2B),使用一當(dāng)量的HCl,并將反應(yīng)混合物稀釋至50 mM,以95% ee得到3a,可以顯著提高對(duì)映選擇性。
催化劑1g使2a的反應(yīng)加速了約30倍。催化劑1g的簡(jiǎn)單硫脲類似物在抑制離子對(duì)坍縮方面模仿了質(zhì)子溶劑。通過(guò)硫脲的S-甲基化合成了5,從而消除了催化劑1g的雙HBD特性,與背景反應(yīng)相比,化合物5沒(méi)有引起速率加速(圖2B,藍(lán)色)。這些觀察結(jié)表明兩個(gè)域的存在以及它們?cè)?strong style=";padding: 0px;outline: 0px;max-width: 100%;box-sizing: border-box !important;overflow-wrap: break-word !important">1g中精確的相對(duì)空間取向?qū)τ诖呋潜匾摹?/span>
(圖片來(lái)源:Nature)
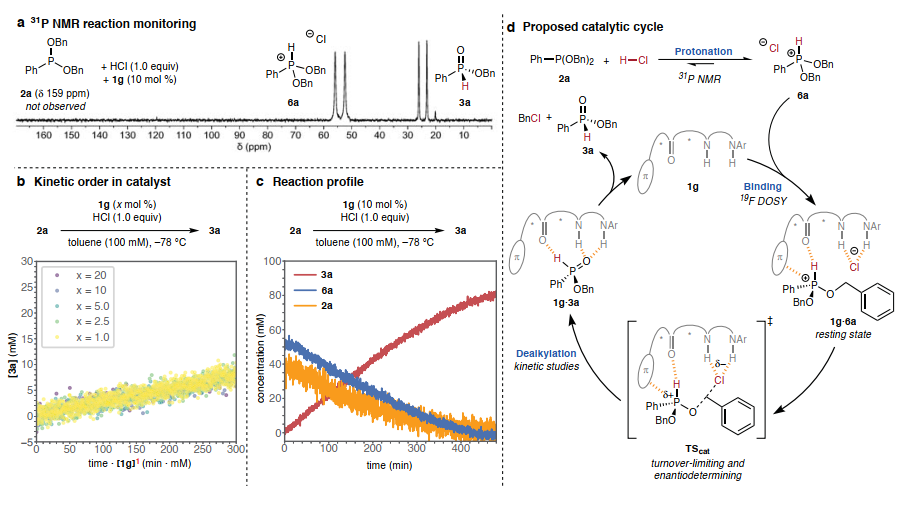
作者進(jìn)行了系統(tǒng)的機(jī)理研究,通過(guò)31P NMR監(jiān)測(cè)2a與HCl 在硫脲1g催化下的反應(yīng),獲得了催化體系中存在質(zhì)子膦離子的證據(jù)(圖3A)。觀察結(jié)果表明,氯化磷6a是催化條件下底物的靜止?fàn)顟B(tài)。采用擴(kuò)散有序核磁共振光譜法(DOSY)測(cè)量催化劑1g在催化反應(yīng)條件下的擴(kuò)散常數(shù),以此作為估算其分子量的方法,研究了催化劑1g的靜止態(tài)形式(圖3B)。反應(yīng)完成后,測(cè)量的分子量介于單體1g和1:1 1g·3a 復(fù)合物之間,與游離催化劑和產(chǎn)物結(jié)合催化劑之間的平衡一致,與強(qiáng)催化劑-產(chǎn)物結(jié)合不一致。這些觀察結(jié)果表明,催化劑1g與6a以1:1的復(fù)合物形式靜止,并且限速脫烷基化反應(yīng)從該復(fù)合物進(jìn)行。
在確定了靜止態(tài)復(fù)合物的分子組成后,作者確定了[1g]T和[6a]的動(dòng)力學(xué)依賴性,以闡明速率決定過(guò)渡態(tài)復(fù)合物的化學(xué)計(jì)量學(xué)(圖3B)。結(jié)果表明反應(yīng)速率表現(xiàn)出對(duì)催化劑[1g]T的一級(jí)依賴性。此外,磷物種6a的消耗和產(chǎn)物3a的形成在反應(yīng)的前~80%中都遵循零級(jí)動(dòng)力學(xué)速率行為(圖3C),與從1:1 1g·6a 靜止態(tài)復(fù)合物進(jìn)行的周轉(zhuǎn)限制和對(duì)映決定脫烷基化過(guò)渡態(tài)一致。圖3D描繪了與所有可用機(jī)制數(shù)據(jù)一致的催化循環(huán)。該循環(huán)的特點(diǎn)是:(i)質(zhì)子化平衡有利于氯化磷6a,(ii) 6a與單體催化劑1g結(jié)合形成靜止?fàn)顟B(tài),(iii)周轉(zhuǎn)限制和對(duì)映決定脫烷基化形成產(chǎn)物3a和芐基氯,它們從催化劑上分離,從而完成催化循環(huán)。
催化劑1g的尺寸相對(duì)較小,使得SN2步驟可以通過(guò)DFT進(jìn)行明確建模(圖4A)。在沒(méi)有催化劑的情況下,發(fā)現(xiàn)氯化磷6a以緊密離子對(duì)的形式靜止,具有籠狀結(jié)構(gòu),其中氯陰離子與陽(yáng)離子發(fā)生多種穩(wěn)定相互作用。必須犧牲所有穩(wěn)定的 H 鍵相互作用和基態(tài)中存在的相當(dāng)一部分庫(kù)侖引力,其方式與鹵化酶反應(yīng)中從水介質(zhì)中脫溶大致類似,以實(shí)現(xiàn) SN2機(jī)制所要求的線性幾何形狀。在考慮這種幾何重組時(shí),協(xié)同脫烷基化途徑可以在概念上分為離子對(duì)重組階段和隨后的離子對(duì)崩潰階段。這兩個(gè)階段可以用位于計(jì)算的本征反應(yīng)坐標(biāo)上的非穩(wěn)態(tài)6a’來(lái)劃分,其中氯離子位于SN2軌跡上,但C-O鍵的形成尚未開始。通過(guò)此分析,>75%的整體電子活化能壘來(lái)自第一階段中氯離子的重組,而對(duì)應(yīng)于共價(jià)鍵斷裂和形成事件的離子對(duì)坍縮階段對(duì)整體能壘的貢獻(xiàn)小于 25%(約 4 kcal/mol)。
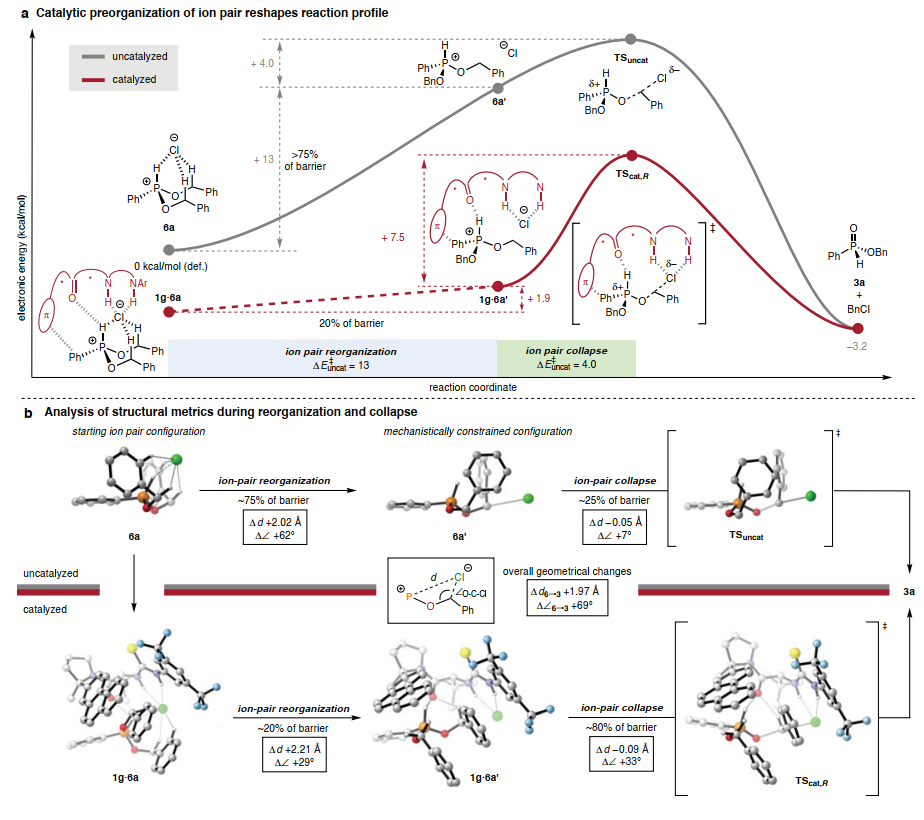
圖4. 催化速率加速的起源
在催化途徑的計(jì)算模型中,發(fā)現(xiàn)親核取代以兩個(gè)離散步驟進(jìn)行(圖4A)。氯化磷靜息態(tài)復(fù)合物1g·6a’的幾何特征與6a’非常相似,即氯化物通過(guò)氫鍵定位在接近最佳的過(guò)渡態(tài)前幾何結(jié)構(gòu)中(圖4B),準(zhǔn)備進(jìn)入TScat,R。因此,催化劑1g可以被視為參與了吸引性非共價(jià)相互作用網(wǎng)絡(luò),從而獲得了相對(duì)穩(wěn)定的基態(tài)復(fù)合物1g·6a’,該復(fù)合物為脫烷基化反應(yīng)做好了準(zhǔn)備。催化劑結(jié)合提高了離子對(duì)崩塌的障礙相對(duì)于非催化途徑,這與預(yù)期的H 鍵對(duì)氯親核性的減弱作用一致。然而,離子對(duì)崩塌的抑制被催化劑減輕了氯化磷離子對(duì)所需的幾何預(yù)組織的能量成本所抵消,導(dǎo)致相對(duì)于背景反應(yīng)的整體加速。
系統(tǒng)的構(gòu)象搜索導(dǎo)致鑒定出低能非對(duì)映體結(jié)構(gòu),從而得到3a的主要(R)和次要(S) 對(duì)映體,其相對(duì)能量與實(shí)驗(yàn)觀察到的對(duì)映選擇性高度一致。導(dǎo)致次要 (S)和主要(R)產(chǎn)物對(duì)映體的非對(duì)映體過(guò)渡態(tài)結(jié)構(gòu)顯示出幾乎相同的催化劑幾何形狀,但與催化劑活性位點(diǎn)內(nèi)磷離子的120度旋轉(zhuǎn)有關(guān)。雖然TScat,S和TScat,R都具有幾個(gè)共同的非共價(jià)吸引相互作用,但TScat,S 在芐基C-H和酰胺氧之間具有一個(gè)額外的H鍵相互作用,而TScat,R 結(jié)合了兩個(gè)芐基C-H–π相互作用。因此,失去一個(gè)芐基C-H氫鍵相互作用和獲得兩個(gè)芐基C-H–π 相互作用的凈能量效益被認(rèn)為在決定對(duì)映誘導(dǎo)的意義和大小方面起著關(guān)鍵作用。
最后,考察了底物范圍。多種二芐基亞膦酸酯被證明可用作底物,提供空氣和水分穩(wěn)定的手性H-亞膦酸酯產(chǎn)品,可通過(guò)硅膠柱色譜法純化(圖5A)。各種對(duì)位取代的芳基亞膦酸酯經(jīng)過(guò)脫烷基化,產(chǎn)率和對(duì)映選擇性良好(3a-3g),對(duì)于具有強(qiáng)吸電子取代基的底物(3h-3j),對(duì)映選擇性較低。間位取代的苯基亞膦酸酯經(jīng)過(guò)脫烷基化,對(duì)映選擇性與對(duì)位取代的區(qū)域異構(gòu)體(3k-3m)相當(dāng)。鄰氟取代將對(duì)映選擇性從90% (3f)降低到73% ee (3n),而鄰苯基取代則降低了對(duì)映選擇性(3o)。然而,帶有鄰位稠合多芳族取代基的底物經(jīng)歷了高對(duì)映選擇性的脫烷基化(3p和3q)。該方法還適用于各種雜芳族和多芳族取代基(3r-3t和3v)。具有非芳基取代基的膦酸酯,可進(jìn)行脫烷基化,具有中等水平的對(duì)映選擇性,而烷基取代基,如環(huán)丙基和甲基,則分別具有54%和30% ee的低水平對(duì)映選擇性。2a的對(duì)映選擇性脫烷基化在克級(jí)規(guī)模上成功進(jìn)行,僅使用3 mol % 1g,具有高對(duì)映選擇性(93% ee)、產(chǎn)率(98%)和高效催化劑回收率(95%)。作者探索了(R)-芐基苯基亞膦酸酯3a作為正交雙功能化的P-立體結(jié)構(gòu)砌塊的反應(yīng)性。發(fā)現(xiàn)它適用于一系列P-H部分的立體特異性合成工藝,然后對(duì)P-OBn部分進(jìn)行二次衍生化(圖5B)。基于已建立的膦酸酯的磷化Mannich反應(yīng)性,用苯酚鋰去質(zhì)子化使3a能夠參與Pudovik加成 Eschenmoser鹽,得到α-氨基膦酸酯7a。隨后可以在甲基鋰存在下取代7a的芐氧基以得到8a,從而保留磷處的對(duì)映體富集。用親核試劑如芐胺和酪氨酸來(lái)獲得具有高產(chǎn)率和對(duì)映特異性的膦酸酯和膦酰胺9a/b。為了研究磷酰基介導(dǎo)的反應(yīng)性,將苯酚鋰條件調(diào)整為先前報(bào)道的H-膦酸酯和苯醌之間的1,6-偶聯(lián),獲得了具有優(yōu)異立體特異性的O-磷酰基對(duì)苯二酚衍生物10a。該結(jié)果表明,在沒(méi)有手性控制元素的情況下,3a衍生的磷酰基具有足夠的構(gòu)型穩(wěn)定性來(lái)參與立體特異性反應(yīng)。最后,對(duì)3a進(jìn)行硫化-甲基化序列,得到具有優(yōu)異對(duì)映特異性的硫代膦酸酯11a。
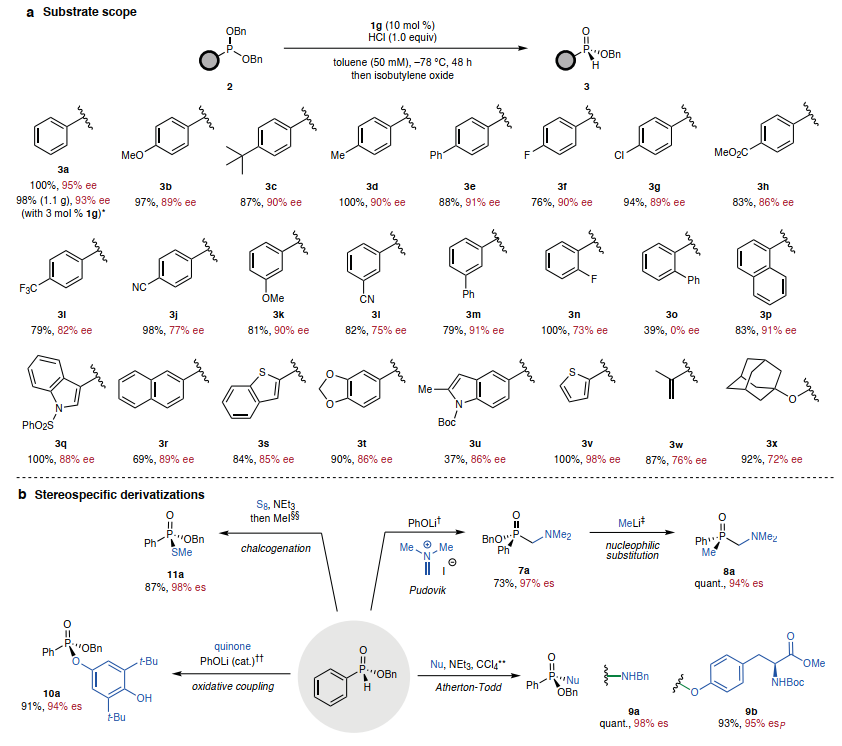
(圖片來(lái)源:Nature)
總結(jié)
聲明:化學(xué)加刊發(fā)或者轉(zhuǎn)載此文只是出于傳遞、分享更多信息之目的,并不意味認(rèn)同其觀點(diǎn)或證實(shí)其描述。若有來(lái)源標(biāo)注錯(cuò)誤或侵犯了您的合法權(quán)益,請(qǐng)作者持權(quán)屬證明與本網(wǎng)聯(lián)系,我們將及時(shí)更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn