


(圖片來源:J. Am. Chem. Soc.)
正文
Scabrolide A(1)是一種有趣的降西松烷類化合物,來源于Sinularia屬的軟珊瑚。利用了早期的生物合成考慮,1是通過雙鍵異構化從Scabrolide B(2)中衍生出來的(Figure 1)。雖然這種轉化可以幾乎定量的收率實現,但作者注意到了一個令人困惑的不一致:合成1與Scarrolide A完全對應,但其前體2與推測的Scarrolid B根本不匹配。基于DFT計算研究發現,作者對Scarrolid B(2)的結構進行了修訂,重新定義為Scarrolid B(3)。天然產物Scabrolide B(3)與Scabrolide A(1)的顯著不同之處在于,它具有6?7?5而不是7?6?5的碳三環骨架。因此,它與Sinuscalide C(4)及其脫水子類密切相關,也與Fragilolide A(5)密切相關,其中C3酮被還原。除了這種結構差異之外,1和3的C12立體中心具有相反的構型,從而能夠將Scabrolide B(3)與Inelenolide(6)區分開來。化學加_合成化學產業資源聚合服務平臺,歡迎下載化學加APP關注。

(圖片來源:J. Am. Chem. Soc.)
最初,作者對Scabrolide A(1)的合成路線進行一些調整,其也可能合成Scabrolide B(3)。具體來說,1的中心六元環是通過閉環復分解(RCM)構建。將所得烯烴化合物8進行羥基導向環氧化,然后進行堿誘導開環,以實現不協調的1,4-二氧化模式(Scheme 1A)。通過上述幾個步驟,可將化合物10轉化為目標產物。然而,這種策略不能延伸到Scabrolide B的合成(Scheme 1B)。雖然二烯化合物11能夠順利進行了閉環,但在12參與的羥基導向環氧化反應均失敗。同時,化合物13通過RCM制備化合物14的嘗試也未能成功。因此,作者進行了相關的逆合成分析(Scheme 1C)。首先,Scabrolide B(3)可由砌塊A通過分子內烯醇化烯基化/氧化制備。其次,砌塊A可由環化前體B制備。此外,環化前體B可由內酯化合物C與烯酮D通過Michael加成制備。

(圖片來源:J. Am. Chem. Soc.)
砌塊19的合成(Scheme 2)。以環己烯酮(15)與硼酸酯(16)為底物,通過不對稱銠催化1,4-加成反應,可以87%的收率得到中間體17,ee為94%。其次,使用位阻大的LiTMP進行脫質子化后,再使用TMSCl進行淬滅,生成硅基烯醇醚18作為主要異構體(rr ≥ 5:1,無需分離)。隨后,以Pd2(dba)3為催化劑,碳酸二烯丙酯為終端氧化劑,無需任何額外配體,可直接進行Saegusa-型氧化反應,可以兩步56%的總收率得到(R)-Norcarvone砌塊19。
砌塊23的合成(Scheme 2)。以(R)-芳樟醇為底物,按照文獻的工藝(J. Am. Chem. Soc. 2022, 144, 1528; Chem. Rev. 2017, 117, 11753.),可制備中間體21。中間體21在HF·Py/THF與TMSOTf/Et3N/THF條件下進行保護基團替換,可以兩步84%的總收率合成中間體22。中間體22通過進一步的臭氧化與Stork-Zhao烯基化反應,可以兩步69%的總收率得到Z-烯基碘化物中間體23。

(圖片來源:J. Am. Chem. Soc.)
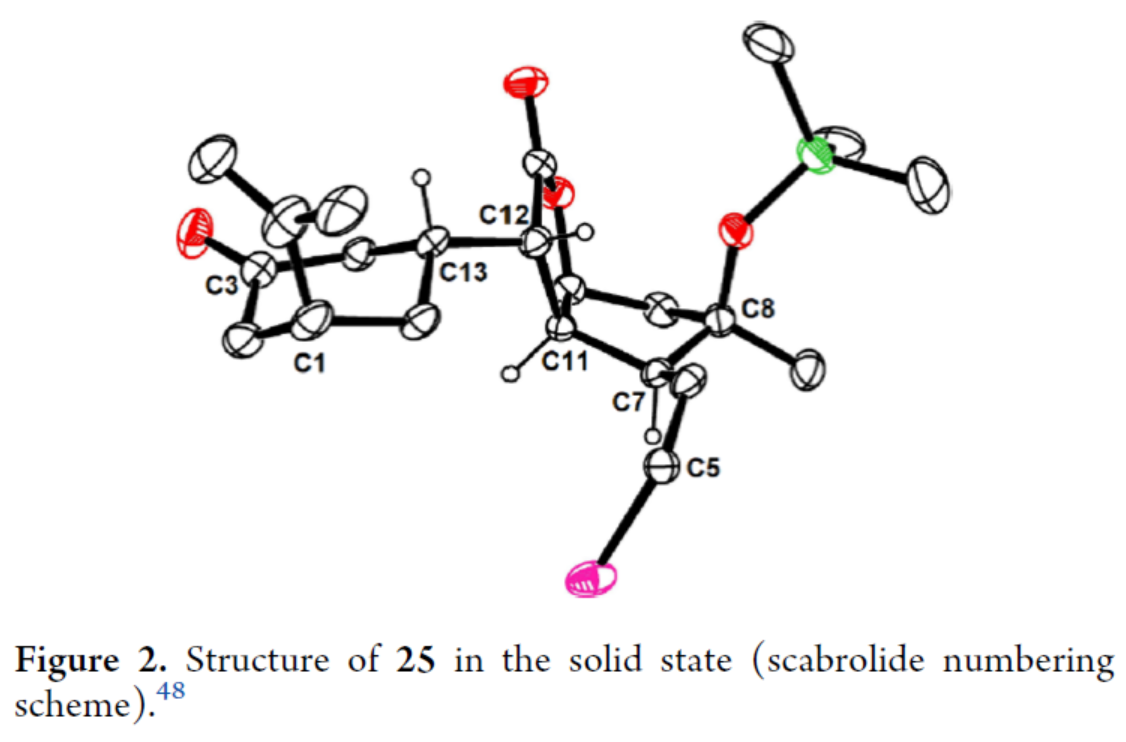
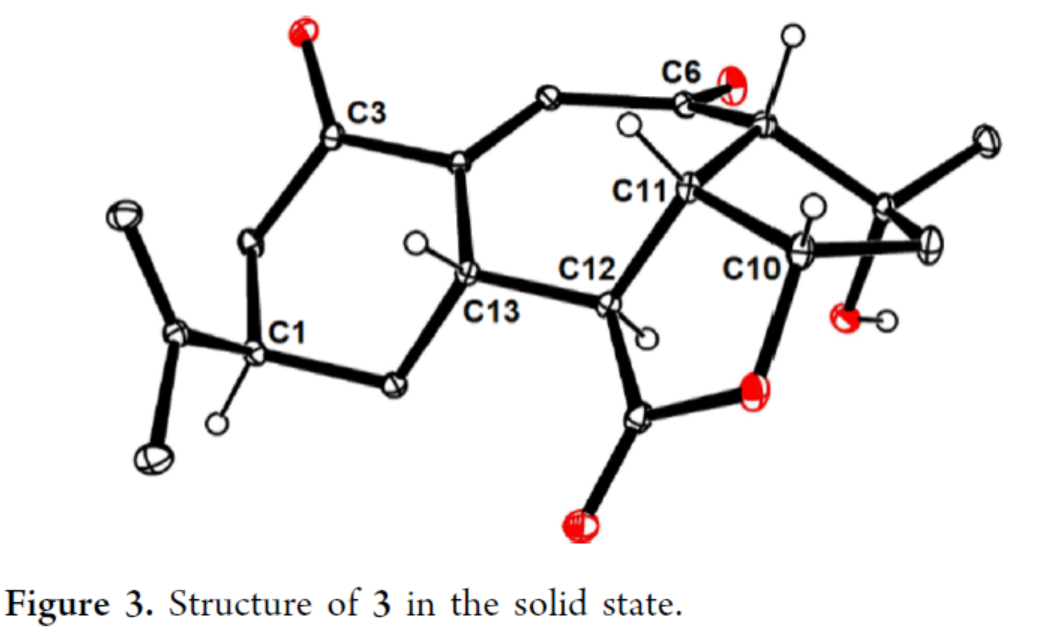
Scarrolid B(3)和Sinuscalide C(4)的全合成(Scheme 3)。以砌塊19和砌塊23為底物,在La(OTf)3/TMP/TIPSOTf條件下進行Mukaiyama-Michael加成反應,并在TBAF/THF條件下進行硅基烯醇醚的選擇性斷裂,可以兩步70%的總收率合成中間體25。同時,通過X-射線單晶衍射分析,作者對位阻較大的C12-C13鍵上新形成的立體中心進行了確證(Figure 2)。通過對反應條件的大量嘗試后發現,中間體25在2,6-二異丙基苯酚(27)/tBuOK/ Pd(PPh3)4條件下進行環化反應,可生成三環烯酮中間體28(收率約60%)和二聚體副產物29(收率為29%),無需進行進一步的分離。通過對反應條件的大量優化后發現,上述的混合物28和29在O2/P(OMe)3/ DBU條件下進行烯丙基重排/氧化反應,可以兩步39%的總收率合成單一的非對映異構體30。中間體30在MeReO3條件下進行1,3-烯丙基重排反應,可以52%的收率得到中間體31。中間體31在MnO2/CH2Cl2條件下進行氧化反應,可以51%的收率得到(?)-3。同時,通過X-射線衍射分析,進一步證明了(?)-3結構的正確性(Figure 3)。(?)-3在Burgess試劑存在下進行脫水反應,可以74%的收率得到Sinuscalide C(4),表征數據和文獻報道的一致。

(圖片來源:J. Am. Chem. Soc.)
(圖片來源:J. Am. Chem. Soc.)
(圖片來源:J. Am. Chem. Soc.)
Ineleganolide(6)和Horiolide(34)的全合成(Scheme 4)。通過對反應條件的大量嘗試后發現,以(?)-3為底物,在Et3N/MeOH/MeCN條件下進行串聯反應,包括C8?OH基團在烯酮上的oxa-Michael加成反應和C12立體中心的差向異構化,可以20%的收率得到Ineleganolide(6)。Ineleganolide(6)通過進一步的retro-oxa-Michael反應,得到中間體32,32接著發生retro-aldol反應,得到中間體33,33再發生Michael加成,可以25%的收率得到Horiolide(34)。

(圖片來源:J. Am. Chem. Soc.)
總結
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn