




正文
α-芳基酰亞胺骨架廣泛存在于各種生物活性化合物中(Figure 1a)。特別是,α-芳基戊二酰亞胺在靶向蛋白質(zhì)降解領(lǐng)域引起了廣泛關(guān)注。α-芳基戊二酰亞胺是沙利度胺、來那度胺和其他α-N-雜環(huán)戊二酰亞胺等分子設(shè)計(jì)的類似物,它們與E3連接酶Cereblon結(jié)合,誘導(dǎo)靶蛋白的泛素化。前期,α-芳基戊二酰亞胺的合成路線通常需要多步反應(yīng)。其中,利用α-芳基氰基酯進(jìn)行酸性水解和環(huán)化構(gòu)建α-芳基戊二酰亞胺是一種常見的方法(Figure 1b)。同時(shí),2,6-二芐氧基吡啶通過交叉偶聯(lián)進(jìn)行官能團(tuán)化,然后同時(shí)進(jìn)行去芐基和氫化反應(yīng),也是合成α-芳基戊二酰亞胺是另一種常見的方法(Figure 1c)。然而,上述的兩種方法均需使用預(yù)官能團(tuán)化的底物且操作繁瑣。另外,上述兩種方法均未能直接獲得對(duì)映富集的α-芳基戊二酰亞胺。為了解決這些問題,近日,美國(guó)加州理工學(xué)院Sarah E. Reisman課題組報(bào)道了一種鎳催化酰亞胺親電試劑和(雜)芳基鹵化物的不對(duì)稱還原交叉偶聯(lián)(RCC)反應(yīng),合成了一系列對(duì)映富集的α-芳基戊二酰亞胺,親電試劑對(duì)的合理選擇使得反應(yīng)具有良好的收率和對(duì)映選擇性(Figure 1d)。歡迎下載化學(xué)加APP到手機(jī)桌面,合成化學(xué)產(chǎn)業(yè)資源聚合服務(wù)平臺(tái)。
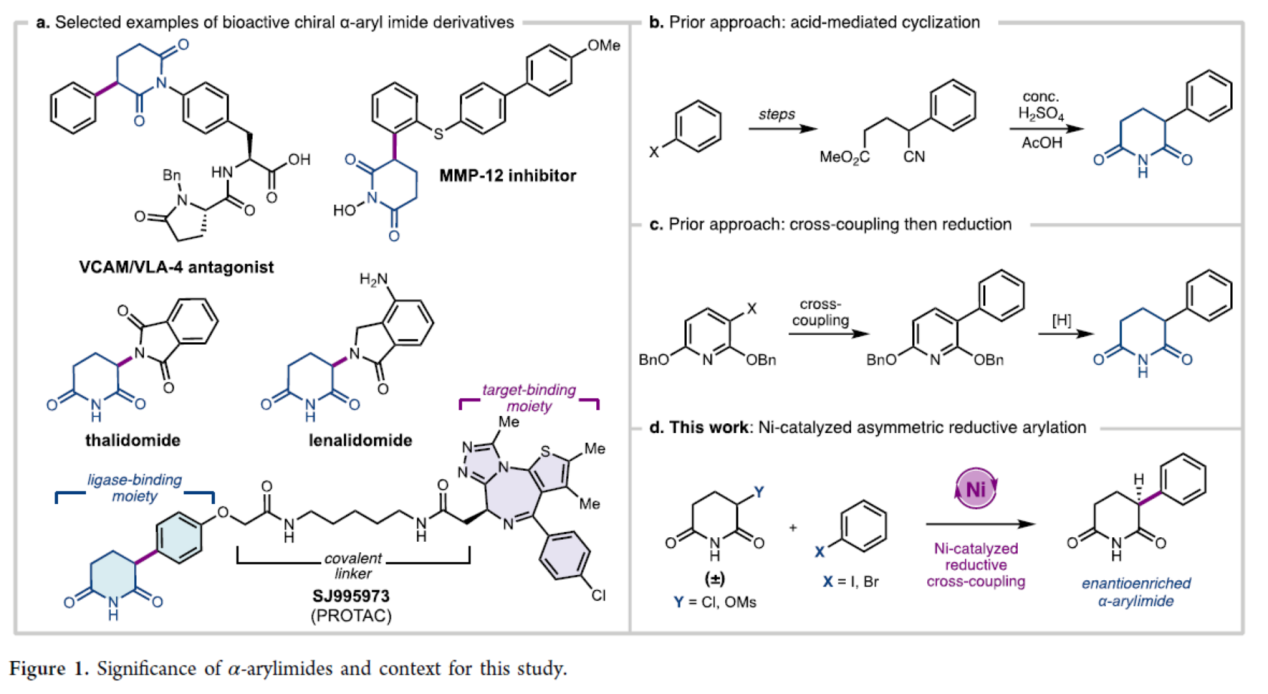
(圖片來源:J. Am. Chem. Soc.)
首先,作者以3-氯哌啶-2,6-二酮1與4-碘甲苯2a作為模型底物,進(jìn)行了相關(guān)反應(yīng)條件的篩選(Table 1)。當(dāng)以NiBr2·diglyme(10 mol %)作為鎳預(yù)催化劑,(R)-L1(11 mol %)作為配體,Zn0(1.5 equiv)作為終端還原劑,TMSCl(0.8 equiv)作為添加劑,在DMA/THF的混合溶劑中18 oC反應(yīng)2 h,可以85%的收率得到α-芳基戊二酰亞胺產(chǎn)物5a,ee為94%。
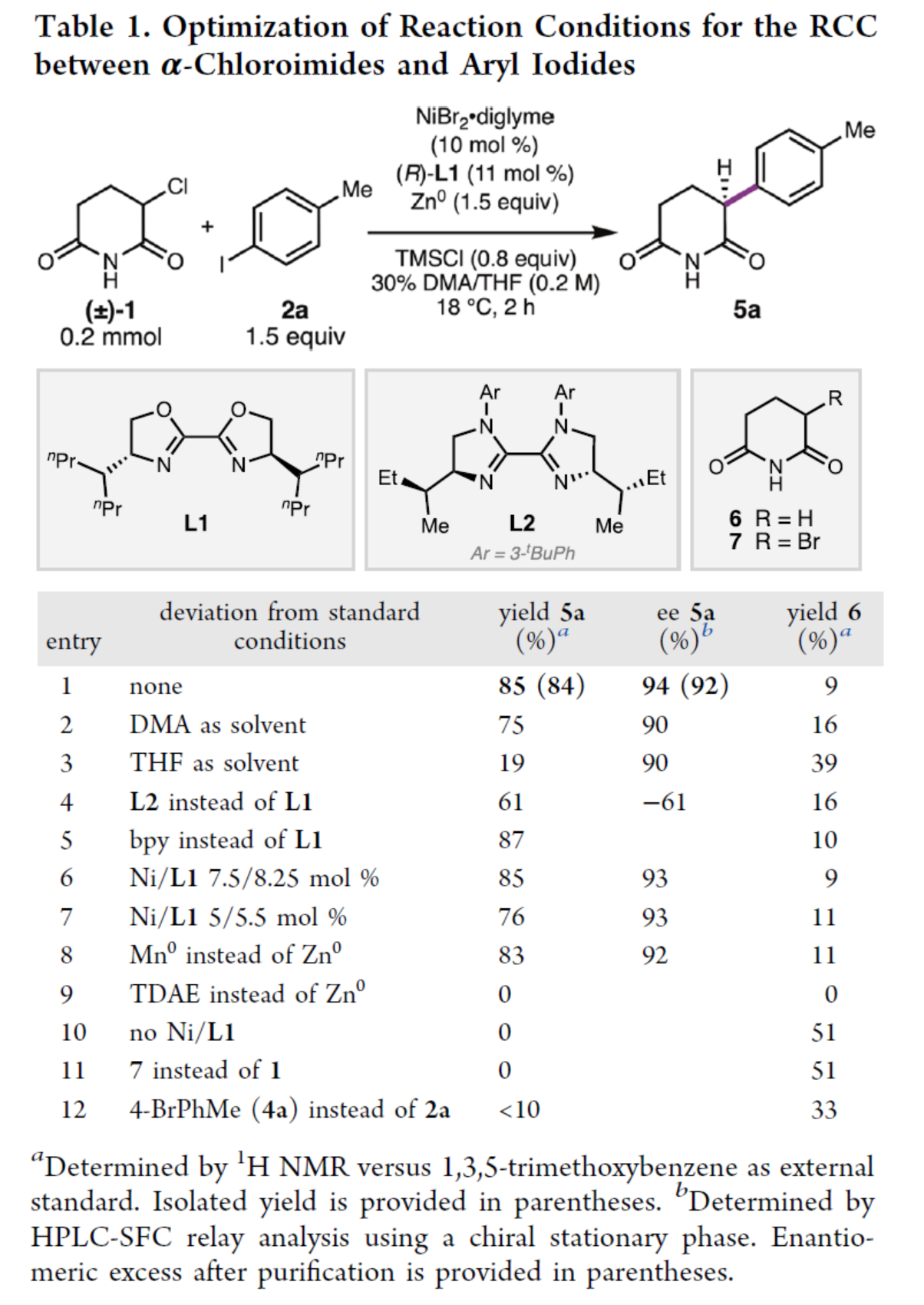
(圖片來源:J. Am. Chem. Soc.)
在獲得上述最佳反應(yīng)條件后,作者對(duì)底物范圍進(jìn)行了擴(kuò)展(Figure 2)。在Method A條件下,一系列不同電性取代的芳基碘,均可順利進(jìn)行反應(yīng),獲得相應(yīng)的產(chǎn)物5a-5v,收率為16-84%,ee為85-96%。其中,由于空間位阻的原因,導(dǎo)致反應(yīng)的效率偏低,如5n、5o和5t。同時(shí),碘代吡啶衍生物,也與體系兼容,獲得相應(yīng)的產(chǎn)物5x-5z和5aa-5ab,收率為9-56%,ee為90-93%。此外,由于缺電子的芳基溴化物應(yīng)比相應(yīng)的芳基碘化物經(jīng)歷更慢的氧化加成反應(yīng),作者認(rèn)為,芳基溴化物可能在反應(yīng)中表現(xiàn)更好。通過下述優(yōu)化的條件(見Table 2,即Method B),一系列不同取代的芳基溴與雜芳基溴化物,也能夠順利進(jìn)行反應(yīng),獲得相應(yīng)的產(chǎn)物5a-5i、5r、5s、5w、5x和5aa-5af,收率為36-72%,ee為63-90%。其中,雜芳基溴化物進(jìn)行反應(yīng)時(shí),反應(yīng)的對(duì)映選擇性通常較低,這可能是由于這些更缺電子的產(chǎn)物在反應(yīng)條件下外消旋化的傾向增加。
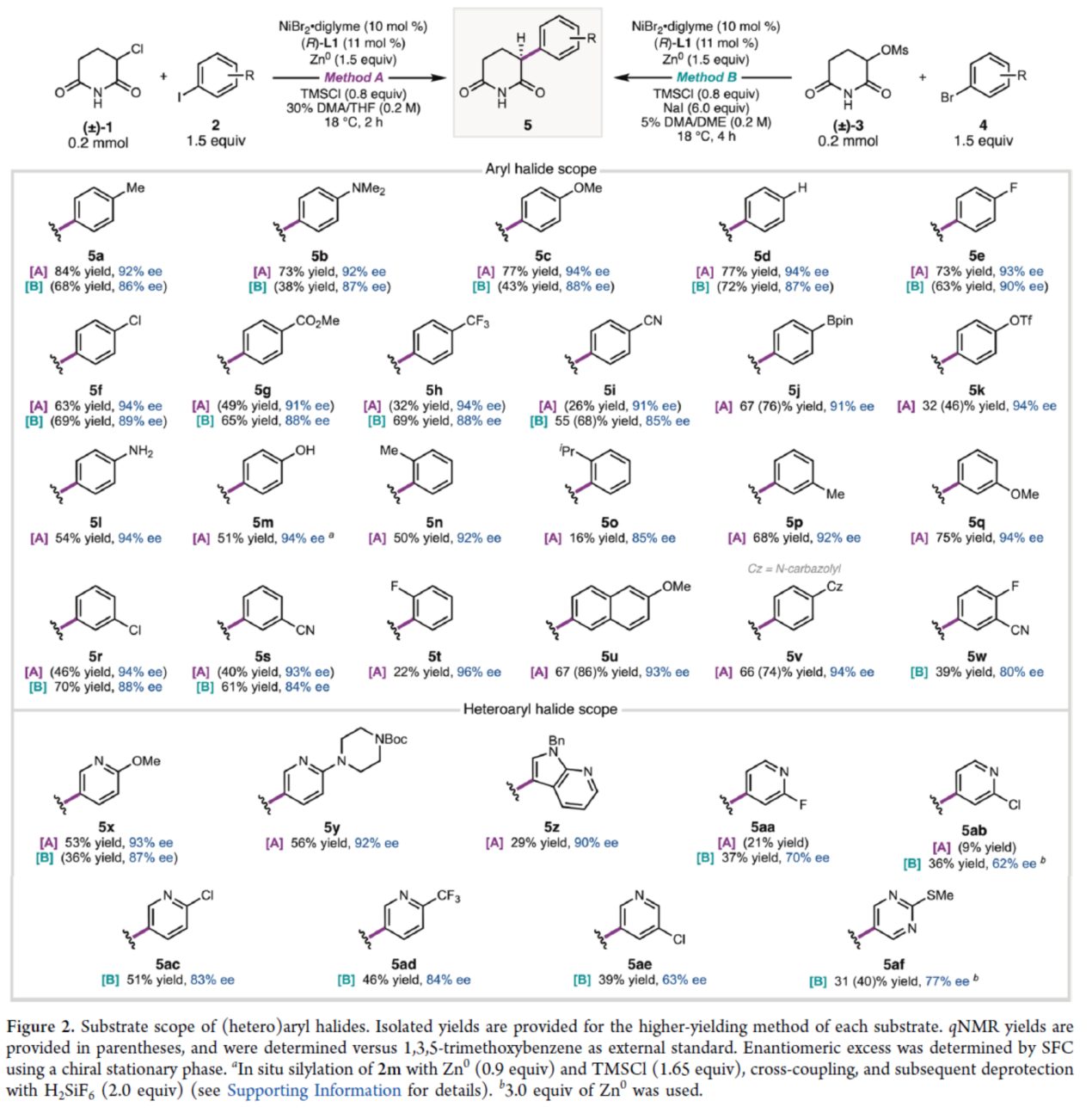
(圖片來源:J. Am. Chem. Soc.)
帶有α-磺酸酯的酰亞胺可以原位轉(zhuǎn)為為α-鹵代酰亞胺,這將有助于保持α-鹵代酰亞胺的濃度較低,從而有效降低總活化速率。為此,作者以α-甲磺酸酯3與芳基溴化物4h作為模型底物,進(jìn)行了相關(guān)反應(yīng)條件的篩選(Table 2)。當(dāng)以NiBr2·diglyme(10 mol %)作為鎳預(yù)催化劑,(R)-L1(11 mol %)作為配體,Zn0(1.5 equiv)作為終端還原劑,TMSCl(0.8 equiv)作為添加劑,NaI(8.0 equiv)作為添加劑(誘導(dǎo)RCC反應(yīng)),在DMA/THF的混合溶劑中18 oC反應(yīng)4 h,可以74%的收率得到α-芳基戊二酰亞胺產(chǎn)物5h,ee為90%。
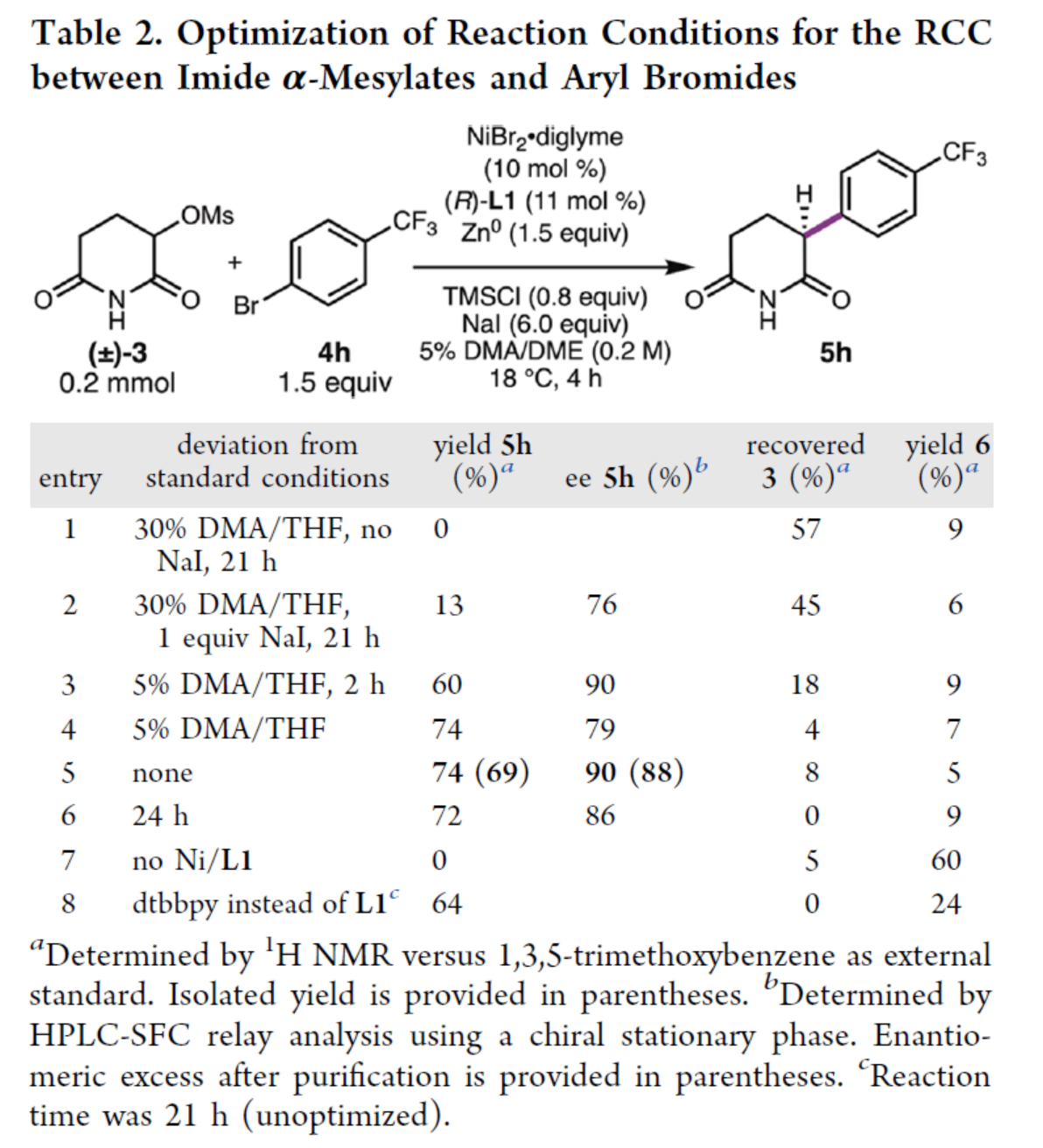
(圖片來源:J. Am. Chem. Soc.)
同時(shí),作者發(fā)現(xiàn),幾種α-取代酰亞胺也可作為有效的偶聯(lián)底物(Figure 3a)。7元環(huán)狀α-氯酰亞胺8a,可以62%的收率與87% ee得到產(chǎn)物9a,而相應(yīng)的5元環(huán)狀底物僅以36%的收率與60%ee得到產(chǎn)物9b。β-取代酰亞胺8c和N-對(duì)甲氧基芐基酰亞胺8d,也能夠順利進(jìn)行反應(yīng),獲得相應(yīng)的產(chǎn)物9c(收率為65%,ee為86%)和9d(收率為50%,ee為92%)。其次,在α′-位含有額外手性中心的α-氯酰亞胺,當(dāng)分別使用(R)-L1和(S)-L1時(shí),可分別以良好的非對(duì)映體選擇性獲得相應(yīng)的反式和順式偶聯(lián)產(chǎn)物9e(Figure 3b)。

(圖片來源:J. Am. Chem. Soc.)
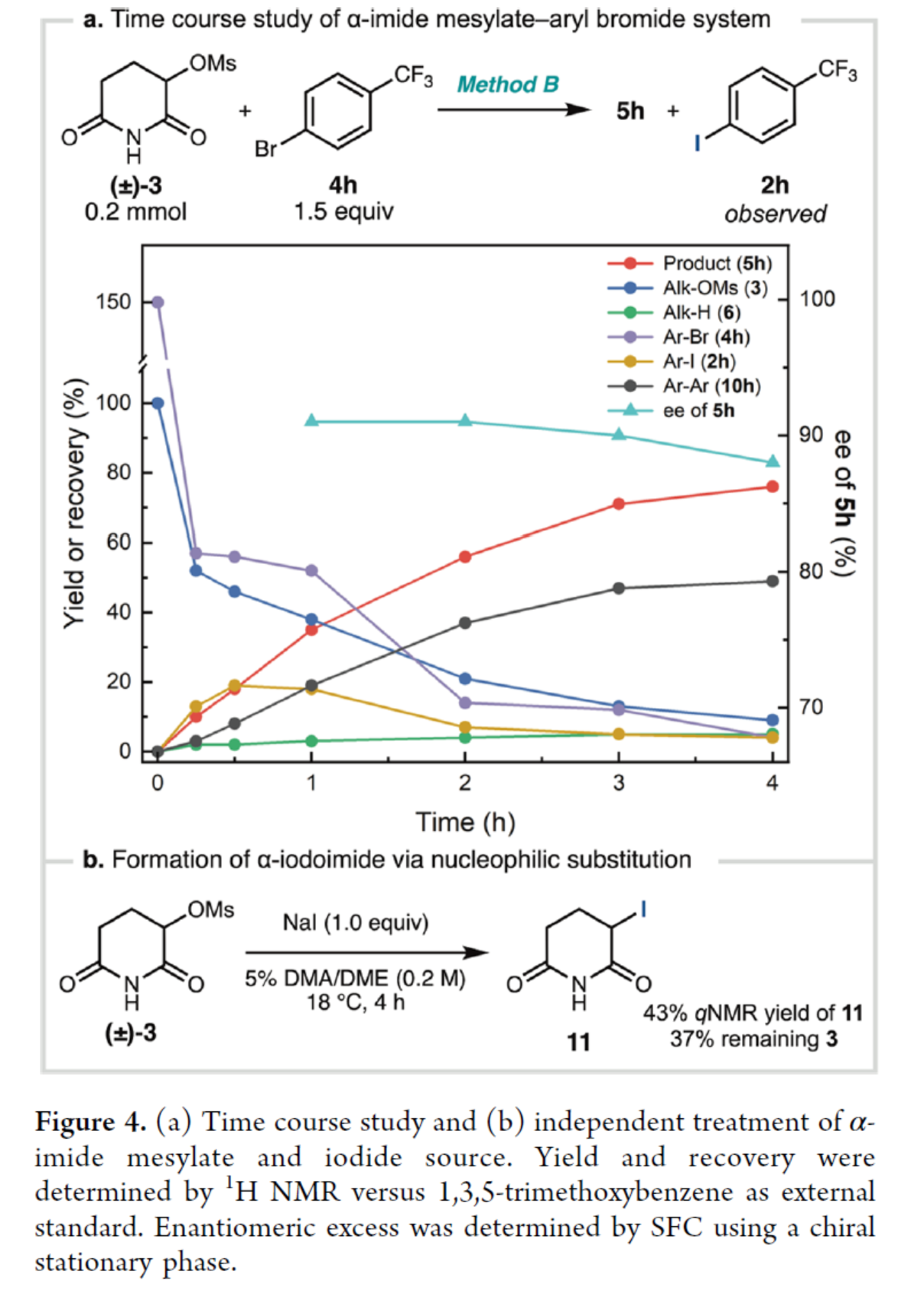
為了進(jìn)一步了解反應(yīng)的機(jī)理,作者對(duì)反應(yīng)的過程進(jìn)行了監(jiān)控(Figure 4a)。在前期,芳基碘2h不斷積累(可能是鎳催化鹵化物交換的結(jié)果),但在后期逐漸衰減。相比之下,在反應(yīng)過程中沒有觀察到由3衍生的α-鹵代酰亞胺,這表明這些物種如果形成,會(huì)被迅速消耗。其次,3在NaI/DMA/DME條件下反應(yīng),可以43%的收率得到α-碘代酰亞胺11(Figure 4b)。作者認(rèn)為,3在原位轉(zhuǎn)化為α-鹵代酰亞胺,其通過L1·Ni配合物進(jìn)行鹵素原子轉(zhuǎn)移(XAT)或被Zn0還原以生成自由基。
基于前期相關(guān)文獻(xiàn)的總結(jié),作者提出了一種可能的反應(yīng)機(jī)理。首先,在L1·NiBr2預(yù)催化劑還原后,L1·NiIX可與芳基鹵化物進(jìn)行氧化加成以及還原,生成L1·NiIIArX配合物。同時(shí),α-鹵代酰亞胺可以通過L1·NiIX配合物的XAT活化,也可以通過Zn0還原,生成α-imidoyl自由基。這種自由基可以被L1·NilArX配合物捕獲,并通過還原消除,從而得到最終產(chǎn)物。
(圖片來源:J. Am. Chem. Soc.)
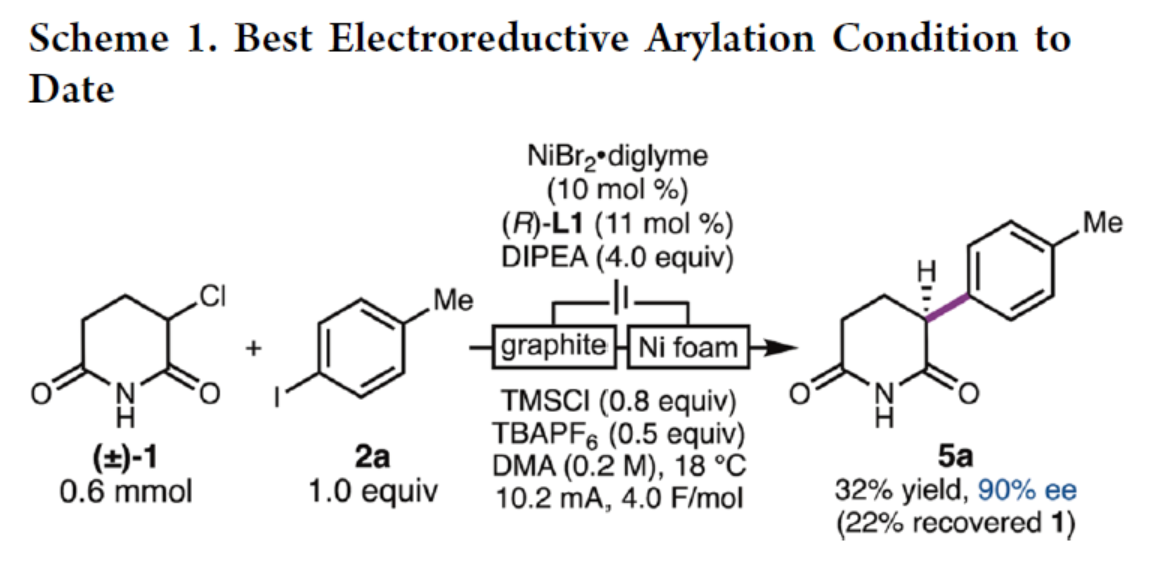
緊接著,作者還使用成對(duì)電解對(duì)電化學(xué)驅(qū)動(dòng)的交叉偶聯(lián)反應(yīng)進(jìn)行了初步研究(Scheme 1)。研究結(jié)果表明,RCC在一個(gè)無(wú)隔膜電解槽中可以32%的收率進(jìn)行,表明了鎳催化劑能夠活化α-氯酰亞胺1。然而,該反應(yīng)的轉(zhuǎn)化率和Faraday效率較低。
(圖片來源:J. Am. Chem. Soc.)
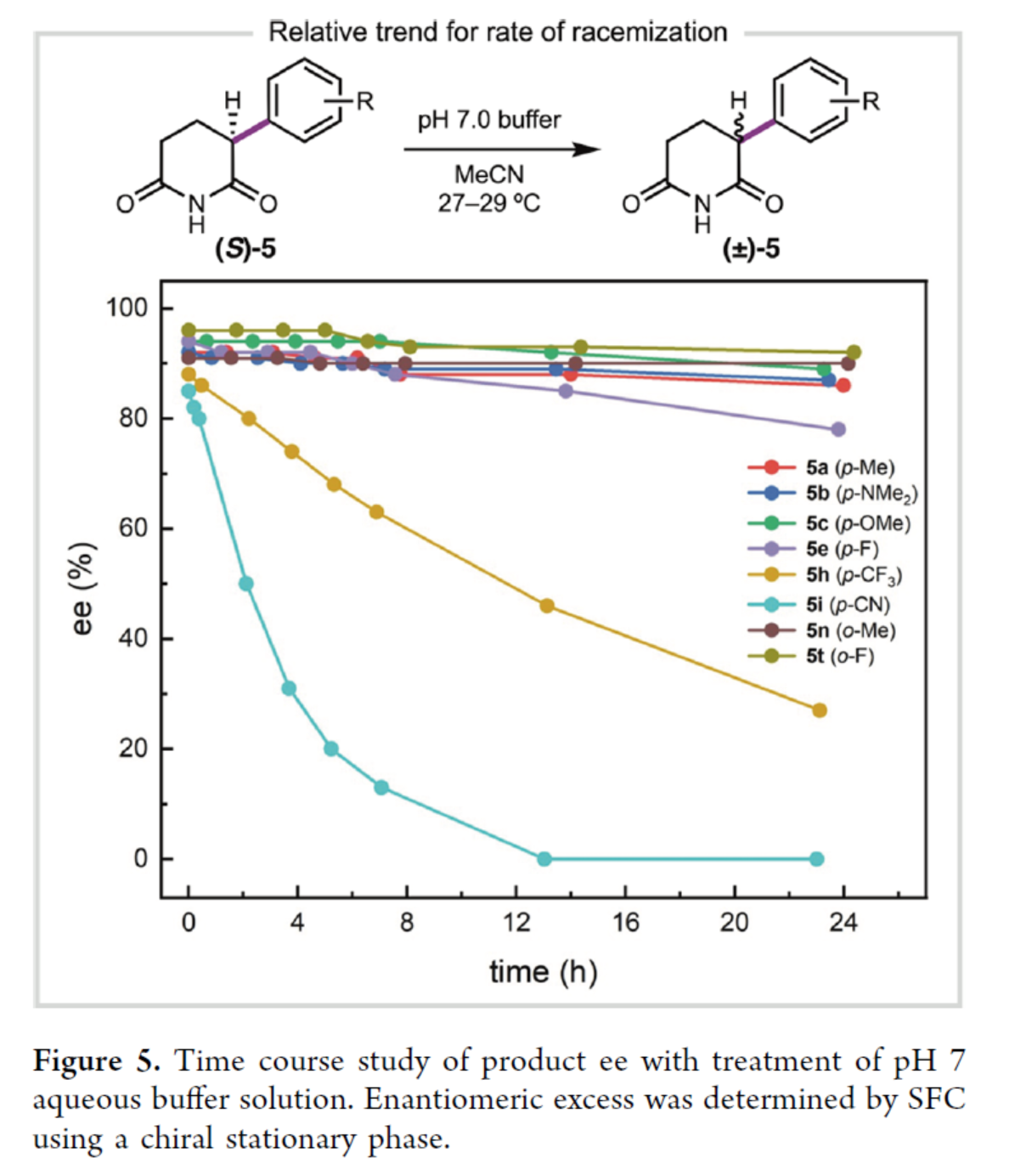
最后,作者將產(chǎn)物5置于pH 7緩沖水溶液中,對(duì)產(chǎn)物5的對(duì)映選擇性隨時(shí)間的變化進(jìn)行了研究(Figure 5)。研究表明,在對(duì)位具有吸電子基的α-芳基酰亞胺在24小時(shí)內(nèi)迅速發(fā)生外消旋,如5h和5i。相反,對(duì)位帶有供電子基的產(chǎn)物是穩(wěn)定的,24小時(shí)后觀察到的外消旋化最小。在鄰位具有取代基的產(chǎn)物(5n和5t)比在對(duì)位具有取代基的產(chǎn)物(5a和5e)表現(xiàn)出更優(yōu)的構(gòu)型穩(wěn)定性,這可能是由于去質(zhì)子化位點(diǎn)的空間位阻增加導(dǎo)致。
(圖片來源:J. Am. Chem. Soc.)
總結(jié)
聲明:化學(xué)加刊發(fā)或者轉(zhuǎn)載此文只是出于傳遞、分享更多信息之目的,并不意味認(rèn)同其觀點(diǎn)或證實(shí)其描述。若有來源標(biāo)注錯(cuò)誤或侵犯了您的合法權(quán)益,請(qǐng)作者持權(quán)屬證明與本網(wǎng)聯(lián)系,我們將及時(shí)更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn